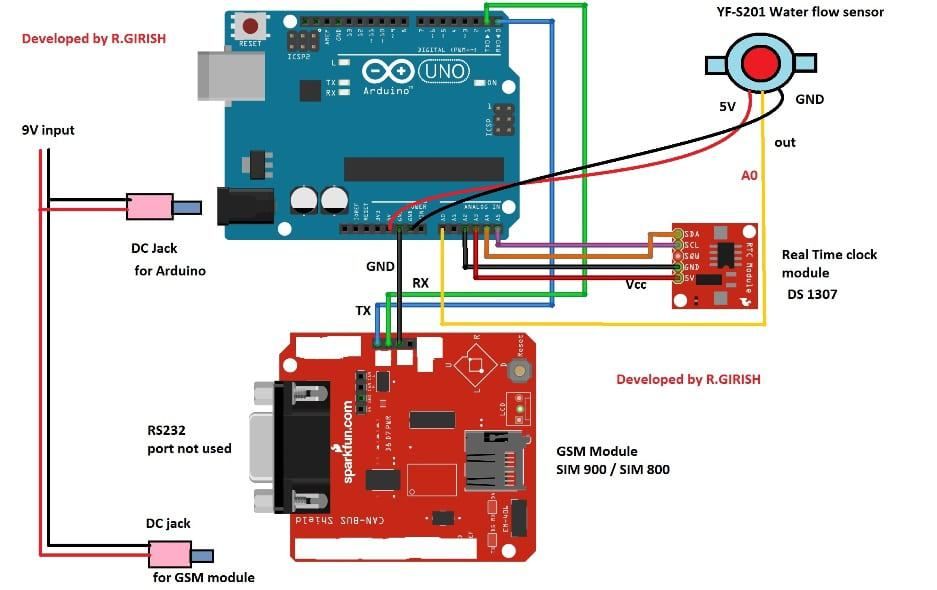
Una cella a secco è la forma più semplice di fonte di produzione di elettricità. Un certo numero di celle combinate insieme forma una batteria. Il piombo-acido o nichel-cadmio batteria è la versione avanzata della cella a secco. Questa cella fu inventata per la prima volta dall'ingegnere francese Georges Leclanche nell'anno 1866. La sua invenzione prese il nome dal suo nome di batteria Leclanche. Ma a quel tempo era molto pesante e poteva essere facilmente rotto. Una pila a secco ha lo stesso principio ed è la versione avanzata della batteria Leclanche ed è disponibile in diversi voltaggi e dimensioni. La forma commerciale della cella zinco-carbone, che è la forma modificata della batteria Leclanche, fu inventata nel 1881 da Carl Gassner di Magonza. Viene prodotto in grandi quantità e utilizzato in molte applicazioni come giocattoli, radio, calcolatrici, ecc.
Cos'è una cella a secco?
Una cella a secco è un dispositivo che genera elettricità in base a reazioni chimiche. Quando i due elettrodi della cella sono collegati tramite un percorso chiuso, la cella forza gli elettroni a fluire da un'estremità all'altra. Il flusso di elettroni fa fluire la corrente nel circuito chiuso.

Strati di cellule secche
Con l'aiuto di reazioni chimiche, gli elettroni fluiscono da un'estremità all'altra. Quando due o più celle, collegate con la corretta polarità, fluiscono più elettroni a causa dell'alto potenziale. Questa combinazione è chiamata batteria. Da una tensione minima di 1,5 V a 100 V, è possibile utilizzare una batteria per ottenere una gamma di tensioni. Anche la tensione CC in uscita della batteria può essere regolata a diversi livelli utilizzando convertitori elettronici di potenza come chopper circuiti.
Struttura della cellula
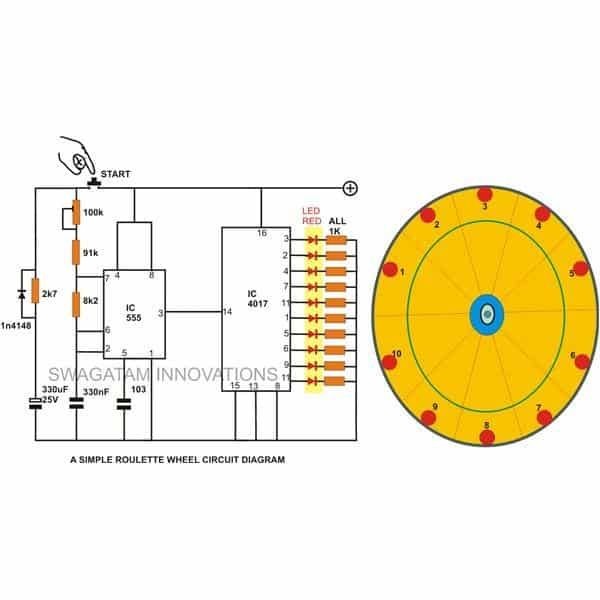
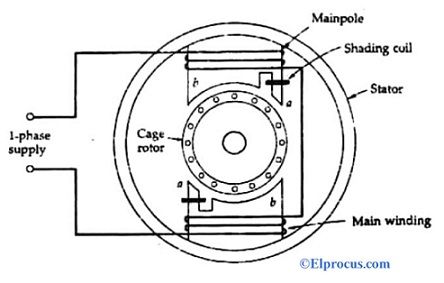
La struttura della cella a secco zinco-carbone è mostrata in figura. È costituito dall'anodo terminale come lo zinco o in generale l'asta di grafite. Il carbonio forma il terminale del catodo. Si può osservare che nelle versioni precedenti della cella a secco lo zinco veniva utilizzato come catodo e la grafite come terminale anodico. La selezione degli elementi si basa fondamentalmente sulla sua configurazione chimica dell'orbita più esterna degli elementi.

Struttura delle cellule secche
Se ha più elettroni di numero nell'orbita più esterna, allora può agire come un donatore e quindi forma il catodo. Allo stesso modo, se l'orbita più esterna ha meno elettroni, può facilmente accettare e quindi forma l'anodo. L'elettrolita posto in mezzo funge da catalizzatore per le reazioni chimiche. In generale, usiamo gelatina di cloruro di ammonio come elettrolita. Nella figura mostrata, l'elettrolita utilizzato è una miscela di zinco e cloruro. Inoltre, il cloruro di sodio viene utilizzato anche come elettrolita. Una miscela di biossido di manganese e carbonio è circondata attorno all'asta dell'anodo.
L'intera configurazione è inserita in un tubo metallico. Si evita che la gelatina si secchi utilizzando una pece nella parte superiore della cella. Una rondella in carbonio è posizionata nella parte inferiore. Lo scopo di questa rondella è impedire che l'asta dell'anodo di zinco venga a contatto con il contenitore.
Questo è anche chiamato un distanziatore come mostrato nel diagramma. La lattina di zinco è inoltre circondata da isolante di carta per scopi di isolamento. Per le batterie di grandi dimensioni vengono utilizzati anche altri materiali isolanti come la mica, ecc. Il terminale positivo dell'ell è formato in alto. Il terminale negativo della cella è formato alla base.
Lavorazione della cella a secco
Una cella secca funziona fondamentalmente sulle reazioni chimiche. A causa delle reazioni che avvengono tra l'elettrolita e gli elettrodi, gli elettroni fluiscono da un elettrodo all'altro. Sostanze come gli acidi si dissolvono in acqua per formare particelle ionizzate. La particella ionizzata è di due tipi. Gli ioni positivi sono chiamati cationi e gli ioni negativi sono chiamati anioni. Gli acidi che vengono disciolti in acqua sono chiamati elettroliti.
Nel diagramma sopra citato, il cloruro di zinco si forma come elettrolita. Allo stesso modo la gelatina di cloruro di ammonio si forma anche come elettrolita. Le barre metalliche immerse negli elettroliti formano degli elettrodi. In base alle caratteristiche chimiche delle barre metalliche, abbiamo un elettrodo positivo come anodo e un elettrodo negativo come catodo.
Gli elettrodi attraggono gli ioni caricati in modo opposto al loro fianco. Ad esempio, il catodo attrae gli anioni e l'anodo attrae i cationi. In questo processo gli elettroni fluiscono da una direzione all'altra, quindi otteniamo un flusso di cariche. Questo è chiamato attuale .
Reazioni chimiche
Di seguito sono riportate le reazioni che avvengono nella cellula. La prima è la reazione di ossidazione.

In questo, il catodo di zinco viene ossidato a ioni di zinco caricati positivamente rilasciando due ioni. Questi elettroni vengono raccolti dall'anodo. Poi arriva la reazione di riduzione.

La reazione di riduzione all'anodo è mostrata sopra. Questa reazione produce una corrente elettrica. Rilascia ioni ossido con ossido di magnesio. Questa reazione si forma quando il magnesio viene combinato con l'elettrolita.


Le altre due reazioni rappresentano una reazione acido-base e una reazione di precipitazione che avvengono nella cella a secco. Nella reazione acido-base, NH è combinato con OH per produrre NH3 insieme all'acqua. I risultati sono NH3 e base acqua.
Differenza tra una cella a secco e una cella umida
La principale differenza tra la cella a secco e la cella a umido è la forma dell'elettrolita. Come discusso in precedenza, in una cella a secco, l'elettrolita come il cloruro di ammonio è di natura secca. Tali celle a secco sono più comuni e utilizzate nei giocattoli, nelle radio, ecc. Ma in una cella umida, l'elettrolito è allo stato liquido.
Vengono utilizzati elettroliti liquidi come l'acido solforico, che è un liquido corrosivo pericoloso. A causa della natura di tali liquidi, la cella umida è di natura più esplosiva e deve essere maneggiata con cura. Il miglior vantaggio di queste celle umide è che possono essere facilmente ricaricate e utilizzate per numerose applicazioni. Tali batterie trovano un uso comune nell'aviazione, nei servizi pubblici, nello stoccaggio di energia e nelle torri dei telefoni cellulari.
Funzioni delle cellule secche
La funzione della cella a secco basata sulle reazioni chimiche tra l'elettrodo e gli elettroliti. Quando gli elettrodi vengono posti negli elettroliti, attrae verso se stessi gli ioni caricati in modo opposto. Ciò causa il flusso di cariche e quindi viene prodotta corrente.
Vantaggi
Il vantaggi della cella a secco include il seguente.
- La cella a secco ha numerosi vantaggi come
- È di piccole dimensioni.
- Può avere una varietà di livelli di tensione.
- È pratico e ha numerose applicazioni.
- È l'unica fonte di tensione CC.
- Può essere utilizzato insieme ai circuiti elettronici di potenza per regolare la tensione di uscita
- È ricaricabile.
Svantaggi
Il svantaggi della cella a secco include il seguente.
- Deve essere maneggiato con cura
- È esplosivo
- Le batterie di grandi dimensioni sono molto pesanti
Applicazioni
Il applicazioni della cella a secco include il seguente.
- Giocattoli
- Aviazione
- Telefono cellulare
- Radio
- Calcolatrice
- Orologi
- Apparecchi acustici
Quindi abbiamo visto il funzionamento, la classificazione e le applicazioni di cellule secche . Un punto interessante da notare è che la batteria funziona solo quando gli elettrodi sono fisicamente in contatto tra loro. Deve esistere un mezzo conduttore tra i due elettrodi. La domanda è: l'acqua può essere utilizzata come mezzo conduttore tra gli elettrodi della cella a secco? In tal caso, cosa succederà se questa cellula viene immersa nell'acqua?